Divulgação, Biozentrum da Universidade de Basileia
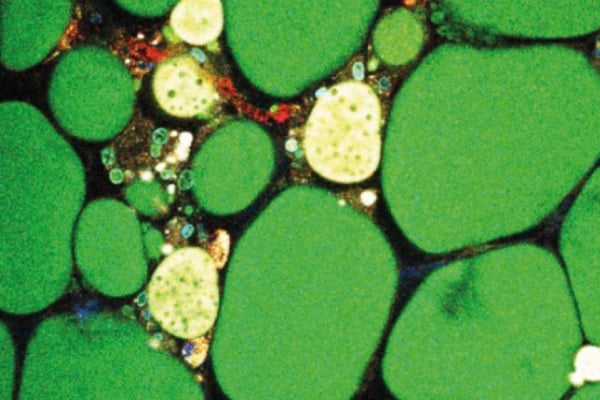
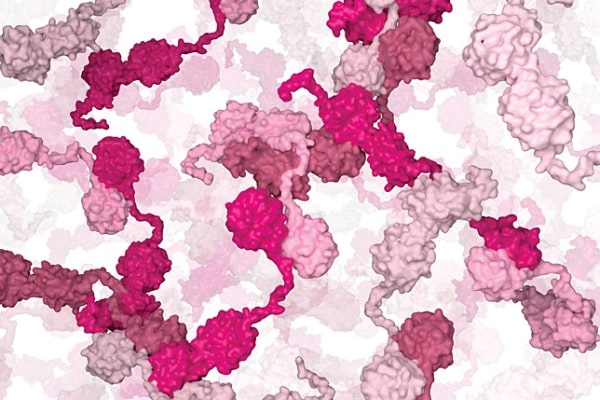
Modelo de formação de gotículas de chaperonas
Fonte
Katrin Bühler, Universidade de Basileia
Publicação Original
Áreas
Compartilhar
Resumo
Ao estudar as funções da chaperona PDIA6 na organização celular, pesquisadores se depararam com a existência das chamadas ‘fábricas de dobramento’ de proteínas, desconhecidas até aqui.
No retículo endoplasmático celular, os pesquisadores descobriram que as chaperonas não se movem isoladamente, mas se auto-organizam em estruturas semelhantes a gotículas, chamadas condensados.
São estes condensados que atraem proteínas desdobradas ou mal dobradas, controlam a eficiência e a qualidade do dobramento e então liberam as proteínas dobradas corretamente.
A ausência das ‘fábricas de dobramento’ pode levar a doenças relacionadas ao dobramento incorreto de proteínas, como doenças neurodegenerativas, diabetes, câncer e fibrose cística.
Foco do Estudo
Estudo
Para realizar sua enorme quantidade de tarefas, as proteínas precisam ser colocadas na estrutura tridimensional correta, ou seja, dobradas corretamente. Esse processo é garantido por um arsenal de assistentes de dobramento conhecidos como chaperonas.
Agora, em um novo estudo, a equipe de pesquisa liderada pelo Dr. Sebastian Hiller no Biozentrum da Universidade de Basileia, na Suíça, demonstrou que certas chaperonas se reúnem em ‘fábricas de dobramento’, que guiam proteínas recém-sintetizadas para sua forma correta.
O ponto de partida para a pesquisa foi uma observação clínica: em várias famílias com doenças genéticas – incluindo fibrose hepática, diabetes e deficiências cognitivas – mutações foram identificadas em uma chaperona específica conhecida como PDIA6.
“Essa observação nos chamou a atenção. Queríamos entender o que a PDIA6 realmente faz na célula, então começamos a estudar sua função”, disse o professor Sebastian Hiller.
O retículo endoplasmático é um compartimento celular dedicado ao dobramento de proteínas, com múltiplas chaperonas para essa finalidade.
Tradicionalmente, acreditava-se que as chaperonas auxiliares de dobramento se moviam individualmente no lúmen do retículo endoplasmático. No entanto, descobrimos que as chaperonas se auto-organizam em estruturas semelhantes a gotículas, chamadas condensados
Resultados
A partir da descoberta da auto-organização das chaperonas na forma de condensados, os pesquisadores observaram que os condensados funcionam como correias transportadoras, com uma estrutura otimizada para o dobramento.
O agrupamento de múltiplas chaperonas é iniciado pela PDIA6. As moléculas de PDIA6 interagem entre si para formar um condensado, que então recruta outras chaperonas.
“Devido à alta concentração de chaperonas nesses condensados, proteínas desdobradas ou mal dobradas são literalmente puxadas para eles”, disse Ana Leder, doutoranda no Biozentrum da Universidade de Basileia e primeira autora do estudo. “Uma vez dobradas corretamente, as proteínas são liberadas da fábrica de dobramento”. Os condensados não apenas aumentam a eficiência do dobramento, como também servem como um sistema de controle de qualidade.
Mas o que acontece quando as fábricas de enovelamento estão ausentes? As células ficam severamente estressadas e, no pior dos casos, até morrem, pois muitas proteínas permanecem desdobradas ou mal dobradas. Os pesquisadores confirmaram esse fato experimentalmente.
“Estudamos a insulina, o hormônio que regula o açúcar no sangue”, disse a doutoranda. “Descobrimos que seu precursor, a pró-insulina, só é dobrado corretamente dentro desses condensados. Em células com mutações na chaperona PDIA6, os condensados não se formam. Como resultado, as células produzem e secretam significativamente menos insulina”. Essas descobertas são consistentes com observações clínicas, nas quais pacientes com mutações no PDIA6 sofrem de diabetes, entre outras condições.
Portanto, as ‘fábricas de dobramento’ são importantes unidades organizacionais dentro do retículo endoplasmático. “Talvez precisemos repensar o conceito do retículo endoplasmático e, possivelmente, de outras organelas celulares também”, afirmou o professor Sebastian Hiller. “Não podemos explicar e compreender completamente a função do retículo endoplasmático sem considerar o papel dos condensados.”
A descoberta da auto-organização das chaperonas é importante para pesquisas futuras e, em longo prazo, tem implicações para aplicações médicas voltadas ao tratamento de doenças relacionadas ao dobramento incorreto de proteínas, como doenças neurodegenerativas, diabetes, câncer e fibrose cística.
Os resultados foram publicados na revista científica Nature Cell Biology.
Esta descoberta é um verdadeiro divisor de águas
Em suas publicações, o Portal SciAdvances tem o único objetivo de divulgação científica, tecnológica ou de informações comerciais para disseminar conhecimento. Nenhuma publicação do Portal SciAdvances tem o objetivo de aconselhamento, diagnóstico, tratamento médico ou de substituição de qualquer profissional da área da saúde. Consulte sempre um profissional de saúde qualificado para a devida orientação, medicação ou tratamento, que seja compatível com suas necessidades específicas.
Autores/Pesquisadores Citados
Instituições Citadas
Publicação
Acesse o artigo científico completo (em inglês).
Acesse a revista científica Nature Cell Biology (em inglês).
Mais Informações
Acesse a notícia original completa na página da Universidade de Basileia (em inglês).
Notícias relacionadas
Universidade de Washington em St. Louis
Universidade Federal de Pernambuco
Universidade Federal do Espírito Santo