Gustavo Henrique Barreto Gimenis, CNPEM
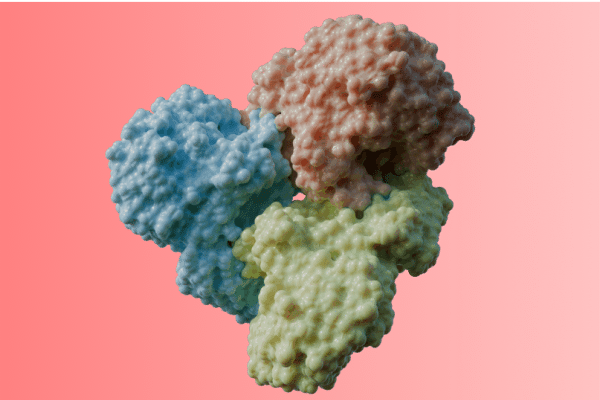
Estrutura tridimensional da enzima metamórfica considerada no estudo
Fonte
Centro Nacional de Pesquisa em Energia e Materiais
Publicação Original
Áreas
Compartilhar
Resumo
Pesquisadores descobriram um mecanismo inédito que controla a atividade de uma enzima envolvida no processamento de nutrientes, especificamente carboidratos, realizado por bactérias da microbiota intestinal da capivara.
Os cientistas combinaram diferentes técnicas experimentais de ponta, que permitiram observar a estrutura da enzima tanto no estado ativo quanto no inativo.
Além de ampliar o conhecimento sobre como bactérias da microbiota intestinal regulam o aproveitamento de nutrientes, a descoberta abre caminho para aplicações inovadoras em biotecnologia.
Foco do Estudo
Estudo
Pesquisadores descobriram um mecanismo inédito que controla a atividade de uma enzima envolvida no processamento de nutrientes, especificamente carboidratos, realizado por bactérias da microbiota intestinal da capivara.
A descoberta surgiu a partir da análise de microrganismos associados à biodiversidade brasileira, um campo ainda pouco explorado e rico em novos sistemas biológicos.
Nesse contexto, os pesquisadores identificaram uma enzima presente em bactérias da microbiota intestinal da capivara, o maior roedor do planeta e endêmico da América Latina, capaz de funcionar como um verdadeiro ‘interruptor molecular’: ela se desliga em ambientes sob estresse oxidativo e volta a funcionar quando as condições se estabilizam.
Na prática, isso acontece porque a enzima tem uma capacidade metamórfica de mudar de forma: em situações sob estresse oxidativo, partes essenciais da sua estrutura se tornam desorganizadas, impedindo o encaixe do substrato e interrompendo a reação bioquímica. Quando o ambiente volta a ser favorável, a estrutura se reorganiza e a atividade é completamente restaurada. O processo é reversível, algo pouco comum nesse grupo de enzimas.
Para compreender esse comportamento, os cientistas combinaram diferentes técnicas experimentais de ponta, que permitiram observar a estrutura da enzima tanto no estado ativo quanto no inativo.
O estudo foi realizado em colaboração entre cientistas do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM), Laboratório Nacional de Biorrenováveis (LNBR), Laboratório Nacional de Biociências (LNBio), Laboratório Nacional de Nanotecnologia (LNNano) e da Universidade Estadual de Campinas (Unicamp), no Brasil; do Centro Nacional de Pesquisa Científica (CNRS) e da Universidade Grenoble-Alpes, na França, e da Universidade de Cambridge. O estudo foi publicado na revista científica Nature Communications.
É como se a enzima tivesse um interruptor molecular de liga e desliga embutido na própria estrutura, que responde às condições químicas do ambiente. Esse mecanismo é mediado por um sítio ativo moldável, que regula sua atividade de forma dinâmica
Resultados
Os experimentos mostraram que essa alternância na enzima depende da formação temporária de uma ligação química interna, conhecida como ligação dissulfeto, que atua como uma chave estrutural para controlar a função da proteína.
O estudo utilizou instalações abertas dos Laboratórios Nacionais do CNPEM (LNBR, LNBio, LNNano), incluindo a linha Manacá, do Sirius, e infraestruturas de Biofísica de Macromoléculas, Criomicroscopia e Microscopia Eletrônica.
Além de ampliar o conhecimento sobre como bactérias da microbiota intestinal regulam o aproveitamento de nutrientes, a descoberta abre caminho para aplicações em biotecnologia, como o desenvolvimento de enzimas mais controláveis para processos industriais e ambientais.
Esse tipo de mecanismo regulatório ajuda a explicar como microrganismos se adaptam a ambientes variáveis e também inspira novas estratégias para o uso de enzimas em processos tecnológicos
Em suas publicações, o Portal SciAdvances tem o único objetivo de divulgação científica, tecnológica ou de informações comerciais para disseminar conhecimento. Nenhuma publicação do Portal SciAdvances tem o objetivo de aconselhamento, diagnóstico, tratamento médico ou de substituição de qualquer profissional da área da saúde. Consulte sempre um profissional de saúde qualificado para a devida orientação, medicação ou tratamento, que seja compatível com suas necessidades específicas.
Autores/Pesquisadores Citados
Instituições Citadas
Publicação
Acesse o artigo científico completo (em inglês).
Acesse a revista científica Nature Communications (em inglês).
Mais Informações
Acesse a notícia origina completa na página do Centro Nacional de Pesquisa em Energia e Materiais.
Notícias relacionadas
Universidade da Pensilvânia